Mit dem 26. Mai 2021 endet die Übergangsfrist der neuen Medizinprodukte-Verordnung 2017/745 (MDR). Diese enthält neben vielen neuen Anforderungen und Verpflichtungen für uns als Hersteller von Medizinprodukten auch gewisse Pflichten, die Sie als Händler erfüllen müssen. Um Sie bei der Umsetzung dieser Vorgaben zu unterstützen, haben wir auf dieser Seite die wichtigsten Informationen im Umgang mit unseren Produkten für Sie zusammengestellt. Diese Informationen sind spezifisch auf unsere Produkte ausgerichtet, die der Klasse I angehören und nicht steril sind. Beim Umgang mit Produkten anderer Hersteller bestehen unter Umständen abweichende Pflichten. Daher finden Sie rechts auch noch einmal den kompletten Text der MDR sowie zwei Leitfäden der DGHIV verlinkt.
Wichtig: Für alle Produkte, die bereits vor dem 26. Mai 2021 bei Ihnen eingetroffen sind, gilt eine rechtlich gültige Abverkaufsfrist bis einschließlich 26.05.2025, sofern die Haltbarkeit unserer Produkte dies erlaubt. Für diese Produkte sind auch die ausgestellten Konformitätserklärungen gemäß der Medizinprodukterichtlinie (93/42/EWG) weiterhin gültig. Die nachfolgenden Regelungen gelten für alle Produkte, die nach dem 26.05.2021 bei Ihnen eingehen. Für diese Produkte erstellen wir eine EU-Konformitätserklärung gemäß der Medizinprodukteverordnung 2017/745 (MDR).
Für die gesetzlich vorgegebene Meldung (mutmaßlich) schwerwiegender Vorkommisse kontaktieren Sie bitte:
Beauftragter für Medizinproduktesicherheit nach § 6 MPBetreibV
Tel. 0951 6047-0
E-Mail bmps@ofa.de
Ihre Händlerpflichten: Sorgfaltspflicht - Prüfpflicht - Informationspflicht
Grundlage dieser Informationen ist der Artikel 14 der MDR. In Zusammenarbeit mit dem Hersteller soll über diese Händlerpflichten gewährleistet werden, dass nur rechtskonforme und sichere Medizinprodukte an die End-Anwender abgegeben werden.
Ihre Pflichten als Händler lassen sich in drei Arten unterteilen. Die Sorgfaltspflicht besagt, dass Sie als Fachhändler ab dem 26. Mai 2021 alle geltenden Regeln der MDR mit der entsprechenden Sorgfalt beachten müssen. Die Prüf- und Informationspflicht umfasst jeweils verschiedene Aufgaben, die wir Ihnen im Folgenden genauer erklären. Einige müssen vor der Abgabe an den Patienten erledigt werden, andere beziehen sich auf die Zeit danach.
Links und Downloads
Infoblätter und Checkliste:
MDR-Informationsblatt für Ofa Händler
Konformitätserklärungen:
(aktualisiert am: 21.05.2025)
Konformitätserklärungen Rundstrick
Konformitätserklärungen Flachstrick
Konformitätserklärungen Orthopädie
Konformitätserklärungen Zubehör
Konformitätserklärung Ofa Fix Hautkleber
Gebrauchsanleitungen:
Gebrauchsanleitungen Stütz- und Kompressionsstrümpfe
Gebrauchsanleitungen Bandagen und Orthesen
Die MDR zum Nachlesen:
DGIHV-Leitfäden zur Umsetzung:
MDR-Leitfaden der DGIHV für Händler
MDR-Leitfaden der DGIHV für Hersteller von Sonderanfertigungen
1. Vor der Abgabe an den Patienten: Prüfung der Konformität
Bevor Sie ein Ofa Produkt abgeben, müssen Sie einige Dinge prüfen. Diese Prüfungen sollten Sie sorgfältig dokumentieren. Es muss nicht jedes Produkt überprüft werden, sondern es ist ein Probenahmeverfahren anzuwenden, das für die von Ihnen angebotenen Produkte repräsentativ ist. Diese Überprüfungen sollten Sie idealerweise direkt bei der Warenannahme machen, bevor Sie die Produkte für die finale Abgabe an den Patienten einlagern.
Vor der Herausgabe eines Ofa Produkts an einen Ihrer Kunden müssen Sie die Konformität dieses Produktes mit der neuen MDR-Richtlinie prüfen. Dazu vergewissern Sie sich, dass für das Produkt eine Konformitätserklärung gemäß der MDR ausgestellt wurde. Für Produkte der Klasse I ist hierfür keine benannte Stelle nötig, sondern Ofa Bamberg stellt eine Konformitätserklärung in alleiniger Verantwortung aus. Mit der Konformitätserklärung erklären wir, dass die davon erfassten Produkte allen für diese Produkte anwendbaren Anforderungen der Medizinprodukteverordnung 2017/745 (MDR) entsprechen. Die unterschriebene Konformitätserklärung ist auch die Grundlage für die CE-Kennzeichnung, ohne eine Konformitätserklärung darf diese nicht erfolgen.
Die Ofa Bamberg Konformitätserklärungen finden Sie rechts in der Downloadübersicht.


Neben dem CE-Kennzeichen müssen Sie als Händler noch einige weitere Kennzeichnungen und Angaben auf unseren Produkten überprüfen. Diese finden Sie auf der Verpackung, dem Verpackungsetikett oder in der Gebrauchsanweisung. Was Sie prüfen müssen:
Trägt das Produkt (Verpackung/Verpackungsetikett) folgende Kennzeichnungen?
1. Name oder Handelsname des Produkts
2. Angaben, aus denen der Anwender ersehen kann, worum es sich bei dem Produkt handelt
3. Name des Herstellers und Anschrift seiner eingetragenen Niederlassung
4. einen Hinweis, dass es sich um ein Medizinprodukt handelt
5. Hinweis auf Lagerung und Handhabung
6. Haltbarkeitsdatum (bei Maßanfertigungen Herstellungsdatum)
Als Händler sind Sie verpflichtet, die Vorgaben zur Lagerung- und Handhabung genauso einzuhalten, wie auf der Kennzeichnung der Produkte ausgewiesen. Über die Einhaltung der Lagerungs- und Handhabungsbedingungen sind entsprechende Nachweise zu führen.

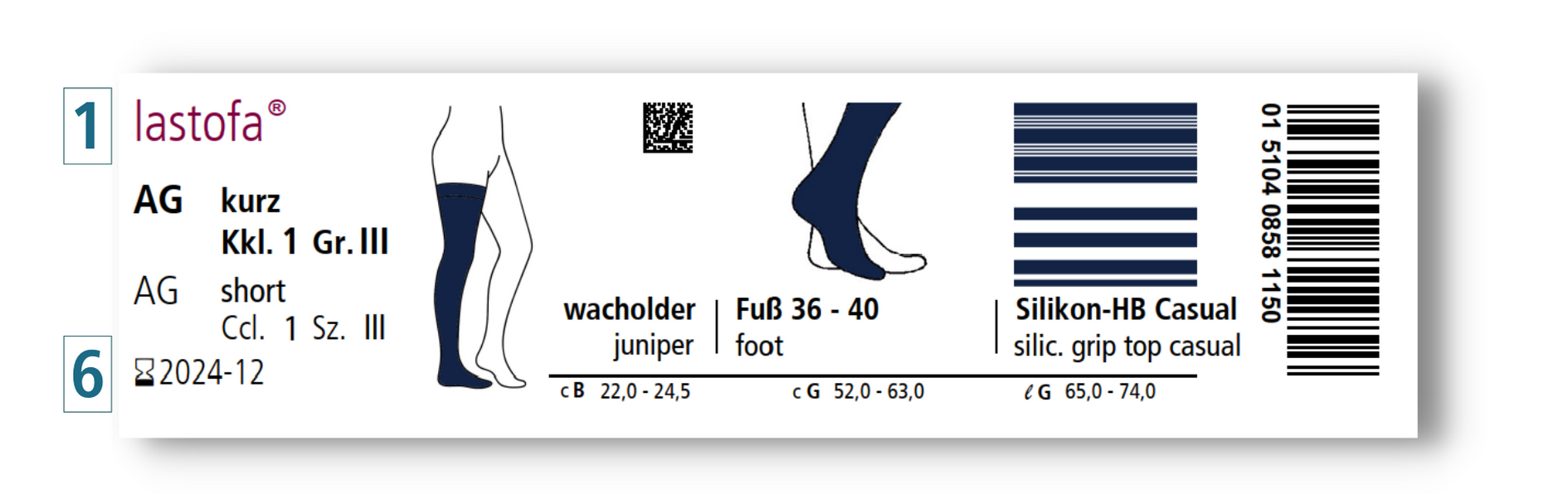
Zudem finden Sie folgendes, neues Label auf unseren Verpackungen:

Dieses zeigt Ihnen auf einen Blick, dass dieses Produkt für die einmalige Abgabe an einen Patienten vorgesehen ist und von genau diesem Patienten mehrfach, gemäß den Anweisungen in der Gebrauchsanleitung, benutzt werden darf.
Liegt eine Gebrauchsanleitung bei?
Allen Ofa Produkten liegt eine ausführliche Gebrauchsanweisung bei. Diese enthält unter Umständen auch eine Montageanleitung für den Fachhandel (in der Regel auf der inneren Umschlagsseite). Mit der Gebrauchsanleitung kommen wir unserer Verpflichtung als Medizinproduktehersteller nach, die Anwendung unserer Produkte und die möglichen Risiken bei der Verwendung verständlich zu erklären. Dazu gehört, dass bei einem Vertrieb ins Ausland diese Informationen in der jeweiligen Amtssprache des Landes vorliegen.
Eine digitale Version unserer Gebrauchsanleitungen stellen wir Patienten auch online zur Verfügung. Die Links zu den Gebrauchsanweisungen aus den verschiedenen Produktbereichen finden Sie oben rechts in der Übersicht.
Enthält die Gebrauchsanleitung alle nach der MDR geforderten Angaben?
Dazu gehören:
1. Name des Produkts
2. Name des Herstellers und die Anschrift
3. Ausstellungsdatum oder Revisionsdatum der Gebrauchsanleitung
4. Informationen zu Lagerung und Handhabung
5. die Zweckbestimmung des Produkts
6. Informationen zu Anwendung, Pflege, Indikationen, Kontraindikationen, Nebenwirkungen, Restrisiken
7. Hinweis zur Meldepflicht beim Hersteller sowie bei den zuständigen Behörden bei schwerwiegenden Vorfällen

Um die Rückverfolgbarkeit von Produkten zu vereinfachen, wurde die sogenannte Unique Device Identification (UDI) eingeführt. Diese besteht unter anderem aus einem maschinenlesbaren Barcode oder Datamatrix-Code, der bestimmte Informationen verschlüsselt. Zu diesen Informationen gehört die GTIN (Global Trade Identification Number, (01)), die das Produkt auf Modellebene eindeutig identifiziert (z.B. Dynamics Carpalorthese, Größe 2, links) sowie das Herstelldatum (11) und die LOT-Nummer (10) des jeweiligen Einzel-Produkts. Zusätzlich müssen diese Informationen dann auch noch einmal in lesbarer Schrift neben dem Code aufgeführt werden. Der Datamatrix-Code und die Informationen in Klarschrift zusammen ergeben die vollständige UDI.
Für Produkte der Klasse I ist diese Kennzeichnung erst ab dem 26.05.2025 verpflichtend. Damit Sie schon vorab einen Eindruck erhalten, wie diese Änderung aussehen wird, sehen Sie hier ein Beispieletikett.
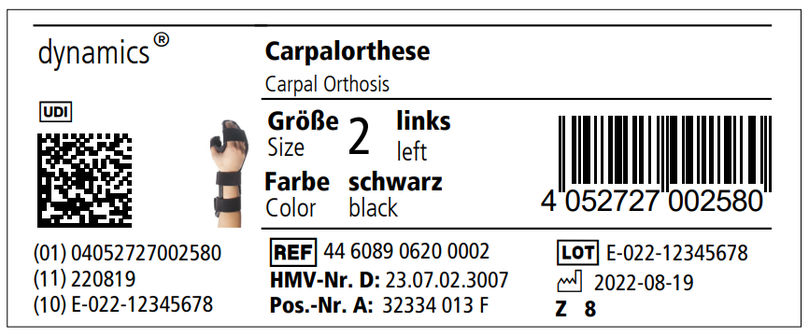
Anhand der Daten der UDI können weitere Informationen zu den Produkten in der zentralen europäischen Datenbank „EUDAMED“ eingesehen werden. Diese steht aktuell jedoch noch nicht im vollen Funktionsumfang zur Verfügung.
Sollten Sie nach Überprüfung der CE-Kennzeichnung, Konformitätserklärung und Gebrauchsanweisung zu der Auffassung kommen, dass diese nicht den Anforderungen der MDR entsprechen, dürfen Sie das Produkt nicht an Patienten herausgeben. Zudem sind Sie verpflichtet, in diesem Fall unverzüglich uns als Hersteller unter vp@ofa.de zu informieren.
Falls von dem Produkt eine schwerwiegende Gefahr ausgeht (siehe Definition weiter unten), müssen Sie als Händler zusätzlich die zuständige Bundesoberbehörde informieren. In Deutschland ist dies das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM). Die Formulare zur Meldung finden Sie auch online auf der Website des BfArM. Genauere Informationen, was ein Vorkommnis, ein schwerwiegendes Vorkommnis oder eine schwerwiegende Gefahr für die öffentliche Gesundheit ist, erfahren Sie im nächsten Reiter.
Darüber hinaus müssen Sie die Nichtkonformität des Produktes dokumentieren. Mehr dazu im Reiter "Beschwerderegister".
Die bisherigen Sorgfaltspflichten, wie z.B. dass beschädigte oder defekte Produkte nicht an den Patienten abgegeben werden dürfen, gelten weiterhin.
2. Nach der Abgabe an den Patienten: Nachverfolgung und Überwachung
Die Konformität ist geprüft, das Produkt abgegeben. Damit sind Ihre Aufgaben als Händler jedoch noch nicht vollständig erledigt. Als erste Anlaufstelle für Patienten sind Sie ein wichtiger Bestandteil der Informations- und Meldekette bei Reklamationen, technischen oder Anwendungs-Problemen und Vorkommnissen. Doch was genau ist ein Vorkommnis?
Im Zuge der MDR hat sich die Definition von Vorkommnis verändert. Zudem wurde der Begriff schwerwiegendes Vorkommnis und schwerwiegende Gefahr für die öffentlich Gesundheit eingeführt. Was diese Begriffe bezeichnen, definiert der Artikel 2 (64.-66.) der MDR:
Vorkommnis
bezeichnet eine Fehlfunktion oder Verschlechterung der Eigenschaften oder Leistung eines bereits auf dem Markt bereitgestellten Produkts, einschließlich Anwendungsfehlern aufgrund ergonomischer Merkmale, sowie eine Unzulänglichkeit der vom Hersteller bereitgestellten Informationen oder eine unerwünschte Nebenwirkung.
Schwerwiegendes Vorkommnis
bezeichnet ein Vorkommnis, das direkt oder indirekt eine der nachstehenden Folgen hatte, hätte haben können oder haben könnte:
a) den Tod eines Patienten, Anwenders oder einer anderen Person,
b) die vorübergehende oder dauerhafte schwerwiegende Verschlechterung des Gesundheitszustands eines Patienten, Anwenders oder anderer Personen,
c) eine schwerwiegende Gefahr für die öffentliche Gesundheit.
Schwerwiegende Gefahr für die öffentliche Gesundheit
bezeichnet ein Ereignis, das das unmittelbare Risiko des Todes, einer schwerwiegenden Verschlechterung des Gesundheitszustands einer Person oder einer schweren Erkrankung, die sofortige Abhilfemaßnahmen erfordert, bergen könnte, und das eine signifikante Morbidität oder Mortalität bei Menschen verursachen kann oder das für einen bestimmten Ort und eine bestimmte Zeit ungewöhnlich oder unerwartet ist.
Als Fachhändler sind Sie verpflichtet, mit uns als Hersteller und den Behörden zusammenzuarbeiten, um Gefahren abzuwenden und Korrekturmaßnahmen zu ermöglichen. Sollten Sie der Auffassung sein oder Grund zu der Annahme haben, dass von einem Produkt eine schwerwiegende Gefahr ausgeht, informieren Sie unverzüglich uns als Hersteller (vp@ofa.de) sowie die zuständigen Behörden der Mitgliedstaaten, in denen Sie das Produkt bereitgestellt haben. Dabei sind insbesondere genaue Angaben zur Nichtkonformität und zu bereits ergriffenen Korrekturmaßnahmen zu übermitteln.
Als Händler von Medizinprodukten sind Sie nach der MDR verpflichtet, gewisse Dinge zu dokumentieren und diese Nachweise auf Anfrage dem Hersteller oder den zuständigen Behörden zur Verfügung zu stellen.Neben der oben genannten Dokumentation der Stichproben-Überprüfungen müssen Sie ein Beschwerderegister führen.
Gehen bei Ihnen also Beschwerden von Angehörigen der Gesundheitsberufe, Patienten oder Anwendern über mutmaßliche Vorkommnisse im Zusammenhang mit einem von Ihnen bereitgestellten Produkt ein, müssen Sie diese nicht nur unverzüglich an uns als Hersteller (vp@ofa.de) und ggf. an die zuständigen Behörden weiterleiten, sondern auch in einem Register vermerken. Neben Beschwerden sind in diesem auch nichtkonforme Produkte sowie Rückrufe und Rücknahmen zu vermerken. Das Beschwerderegister ist in regelmäßigen Abständen uns als Hersteller zu übermitteln.
Achten Sie auf eine detaillierte und für eine dritte Instanz (z.B. eine Behörde) nachvollziehbare Dokumentation. Behörden können von Ihnen auch Muster bzw. Proben der Produkte verlangen, die Sie dann kostenfrei zur Verfügung stellen müssen.
Um die Rückverfolgbarkeit von Produkten zu gewährleisten, müssen Sie folgende Angaben für mindestens 10 Jahre gegenüber den Behörden angeben können:
- alle Wirtschaftsakteure (Hersteller, Händler, Importeure), von denen Sie ein Produkt direkt bezogen haben
- alle Wirtschaftsakteure (weitere Händler, nicht Patienten!), an die Sie ein Produkt direkt abgegeben haben
- alle Gesundheitseinrichtungen oder Angehörigen der Gesundheitsberufe, an die Sie ein Produkt direkt abgegeben haben.
Zudem sind Sie als Händler verpflichtet, mit uns als Hersteller sowie mit den zuständigen Behörden zusammenzuarbeiten, wenn Korrekturmaßnahmen oder Rückrufe von Produkten erforderlich sind.
Das könnte Sie auch interessieren:
Werbung zu Medizinprodukten
Als Händler dürfen Sie bei Werbung und Angaben zu Produkten nur Abbildungen und Informationen verwenden, die von uns als Hersteller für das jeweilige Produkt vorgesehen sind. Abweichungen wie alte oder andere Versionen, die auf irgendeine Art dazu führen können, dass ein falscher Eindruck bezüglich des Produktes und seiner Eigenschaften entsteht, sind verboten.
Bitte berücksichtigen Sie auch, dass Sie keine Informationen verbal oder in schriftlicher Form an die Patienten geben, die als „irreführende Informationen“ betrachtet werden können.
Hierzu zählen u.a Informationen, die
- dem Produkt Funktionen und Eigenschaften zuschreiben, die es nicht besitzt
- einen falschen Eindruck hinsichtlich der Behandlung oder Diagnose und der Funktionen oder Eigenschaften des Produktes erwecken
- den Nutzer oder Patienten nicht über die zu erwartenden Risiken, die mit der Verwendung des Produkts gemäß seiner Zweckbestimmung verbunden sind, informieren
- andere Verwendungsmöglichkeiten für das Produkt empfehlen als diejenigen, für welche angegeben wird, dass sie Teil der Zweckbestimmung sind, für die die Konformitätsbewertung durchgeführt wurde
Aktuelles Bildmaterial zu unseren Produkten finden Sie in unserem Downloadbereich. Um diesen nutzen, ist eine Registrierung erforderlich. Sollten Sie sich noch nicht für unser Fachhandelsportal registriert haben, können Sie dies hier tun.
Meldung (mutmaßlich) schwerwiegender Vorkommisse
Beauftragter für Medizinproduktesicherheit nach § 6 MPBetreibV
Tel. 0951 6047-0
E-Mail bmps@ofa.de



